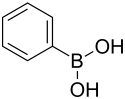
Benzolboronsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Benzolboronsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H7BO2 | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 121,93 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
8,83[4] | |||||||||||||||||||||
| Löslichkeit |
löslich in Wasser (10 g·l−1 bei 20 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Benzolboronsäure, auch bekannt als Phenylboronsäure, ist eine chemische Verbindung aus der Gruppe der Organoboronsäuren.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Es gibt zahlreiche Methoden, um Benzolboronsäure zu synthetisieren. Eine verbreitete Synthese verwendet Phenylmagnesiumbromid und Borsäuretrimethylester zur Bildung des entsprechenden Esters, der dann durch Hydrolyse in Phenylboronsäure umgesetzt wird.[5]
Eine analoge Synthese kann auch ausgehend vom Phenyllithium erfolgen.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Benzolboronsäure ist ein farbloser bis gelblicher geruchloser Feststoff.[1][2] Der Feststoff bildet ein orthorhombisches Kristallgitter mit der Raumgruppe Iba2 (Raumgruppen-Nr. 45).[7] Im Festkörper liegen Dimere vor.[7] Durch trockenes Erhitzen kann die Verbindung unter Wasserabspaltung zum Anhydrat Triphenylboroxin trimerisiert werden.[5][8] Die Reaktion verläuft aus der festen Phase mit einer molaren Reaktionsenthalpie von 41 kJ·mol−1 endotherm.[8]
In Gegenwart von Carbonsäure kann eine säurekatalysierte Deboronierung (Protodeboronierung) erfolgen, wobei ein 6-gliedriger Übergangszustand zusätzlich noch über einen Lewis-Säure-Base Komplex zwischen dem Bor-Atom und dem Sauerstoff der Carboxylfunktion stabilisiert wird. Dieser Mechanismus setzt das Vorhandensein von stöchiometrischen Mengen an Carbonsäure voraus. Allerdings ist zu beachten, dass durch Kondensationsprozesse des als Nebenprodukt resultierenden Borsäurederivates die Essigsäure wieder freigesetzt werden kann und somit auch unterstöchiometrische Mengen für eine quantitative Deboronierung ausreichen können.[9][10]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Benzolboronsäure wird bei zahlreichen Kreuz-Kupplungsreaktionen verwendet. Im Jahr 1979 fanden Miyarura und Suzuki eine Kohlenstoff-Kohlenstoff-Bindung Bildungsreaktion (heute als Suzuki-Kupplung bezeichnet) welche Arylboronsäuren mit Halogenaromaten unter katalytischer Verwendung von Palladium-Phosphan-Komplexen zu Biphenylderivaten oder Vinylaromaten umsetzen.[11]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Phenylboronic acid, purum, 97,0 % (HPLC) bei Sigma-Aldrich, abgerufen am 19. Mai 2017 (PDF).
- ↑ a b c Datenblatt Benzolboronsäure bei Merck, abgerufen am 13. August 2011.
- ↑ Eintrag zu Phenylboronsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. April 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 8-45.
- ↑ a b Robert M. Washburn, Ernest Levens, Charles F. Albright, Franklin A. Billig: Benzeneboronic Anhydride In: Organic Syntheses. 39, 1959, S. 3, doi:10.15227/orgsyn.039.0003; Coll. Vol. 4, 1963, S. 68 (PDF).
- ↑ Cundy, D.J.; Forsyth, S.A.: Cupric acetate mediated N-arylation by arylboronic acids: A preliminary investigation into the scope of application in Tetrahedron Letters 39 (1998) 7979–7982, doi:10.1016/S0040-4039(98)01735-3.
- ↑ a b Rettig, S.J.; Trotter, J.: Crystal and molecular structure of phenylboronic acid, C6H5B(OH)2 in Can. J. Chem. 55 (1977) 3071–3075, doi:10.1139/v77-430, pdf.
- ↑ a b Finch, A.; Gardner, P.J.: Thermochemistry of phenylboronic acid, diphenylborinic acid, and their anhydrides in Trans. Faraday Soc. 62 (1966) 3314–3318, doi:10.1039/TF9666203314.
- ↑ Katritzky, A.R.; Meth-Cohn, O.; Rees, C.W.: Comprehensive Organic Functional Group Transformations, Volume 1, Pergamon Press, 1998, ISBN 978-0-08-042322-7, S. 447
- ↑ Hall, D.G.: Structure, Properties, and Preparation of Boronic Acid Derivatives: Overview of Their Reactions and Applications in Boronic Acids: Preparation and Applications in Organic Synthesis, Medicine and Materials, Volume 1, Second Edition, Wiley_VCH 2011, ISBN 978-3-52-732598-6, S. 14–15.
- ↑ Miyaura, N.; Suzuki, A.: Stereoselective synthesis of arylated (E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst. In: J. Chem. Soc., Chem. Commun. Nr. 19, 1979, S. 866, doi:10.1039/C39790000866.





